- Immunity:新型“可循环”CAR-T疗法显著提高CAR-T细胞持续活性
- 康方生物PD-1/CTLA-4双抗AK104获FDA授予快速审批资格
-
Cell:阿尔茨海默病明星分子TREM2的抗癌机制
- Nature Cancer:合成致死抗癌新靶点SLC33A1
药物开发
Immunity:“可循环”CAR-T疗法显著提高CAR-T细胞持续活性
8月5日,Immunity以封面文章的形式发表了来自上海科技大学王皞鹏课题组等的联合研究,提出了一种“可循环CAR” (Recyclable CAR)新型设计方案,能够显著提高CAR-T细胞在体内的持续活性和抗肿瘤效果,提供了防止CAR-T治疗后肿瘤复发的新策略。
在该项研究中,研究人员首次证明了CAR受体在结合肿瘤抗原后会发生泛素化修饰,引起溶酶体介导的CAR的降解,从而显著下调细胞表面的CAR受体水平。研究人员进一步把CAR胞内段的泛素化位点赖氨酸K突变为精氨酸R(CARKR),阻断了CAR的泛素化修饰及溶酶体降解,抑制了CAR的下调过程,最终CAR会被输送回到细胞表面,实现“循环”。改造后的CAR相较于传统的CAR能够赋予T细胞更强的持续活性和抗肿瘤效果。
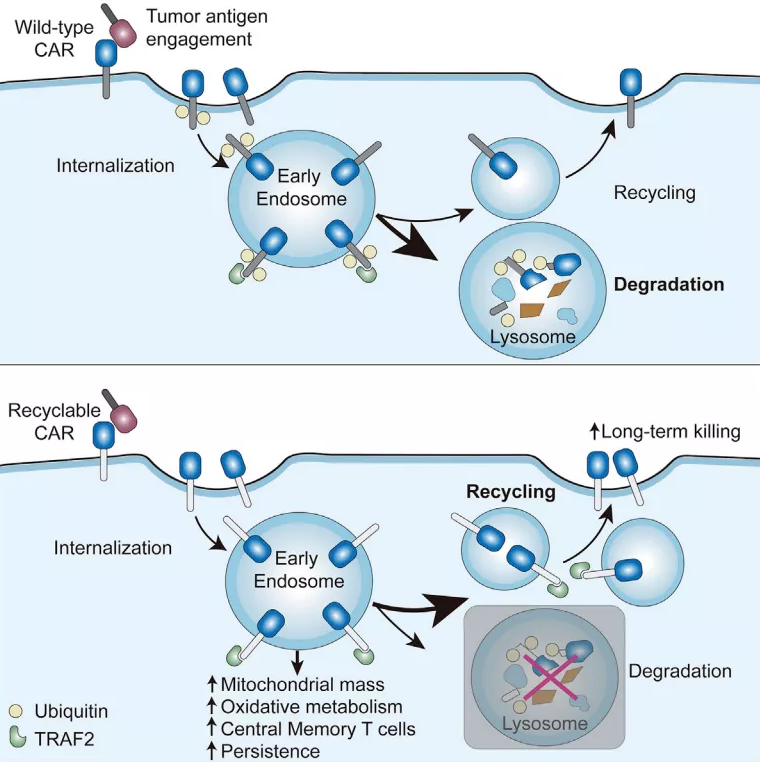
▲“可循环CAR(Recyclable CAR)”原理
(信息来源:
https://www.cell.com/immunity/fulltext/S1074-7613(20)30318-6?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS1074761320303186%3Fshowall%3Dtrue)
康方生物PD-1/CTLA-4双抗AK104获FDA授予快速审批资格
8月14日,康方生物宣布其自主研发、全球首创的PD-1/CTLA-4双特异性抗体新药AK104已经获得FDA授予快速审批通道资格(FTD),作为单一疗法用于治疗经铂类化疗后疾病进展的复发性或转移性鳞状宫颈癌患者。
AK104能够实现与肿瘤浸润淋巴细胞而非正常外周组织淋巴细胞的优先结合。目前在澳洲和中国开展的临床试验中已经显示临床疗效和良好安全性,是肿瘤免疫治疗领域新的尝试和突破。
(信息来源:
http://asia.blob.euroland.com/press-releases-attachments/1243433/HKEX-EPS_20200813_9396020_0.PDF)
第一三共公布HER3 ADC新药联合用药治疗肺癌的I期临床计划
8月6日,第一三共制药宣布,与阿斯利康进入一项临床I期试验合作,评估patritumab deruxtecan(U3-1402)联合Tagrisso(泰瑞沙,通用名:osimertinib,奥希替尼)一线或二线治疗EGFR突变的晚期或转移性非小细胞肺癌(NSCLC)患者。
Patritumab deruxtecan是一种靶向HER3的抗体药物偶联物(ADC)。Patritumab是人源化HER3抗体,deruxtecan是一种新型拓扑异构酶1抑制剂,两者使用一种四肽连接剂偶联,能够在抗体上连接更多毒素,从而可能具有更强杀伤肿瘤的效果。
Patritumab deruxtecan此前在治疗HER3过表达的乳腺癌患者I/II期试验中结果积极,是进展最快的靶向HER3药物之一。
(信息来源:
https://www.daiichisankyo.com/media_investors/media_relations/press_releases/detail/007174.html)
诺华omalizumab单抗成首个靶向IgE治疗慢性鼻窦炎伴鼻息肉的药物
8月6日,诺华(Novartis)宣布,欧盟委员会(EC)已批准omalizumab(奥马珠单抗,商品名:Xolair)作为鼻内皮质类固醇(INC)疗法的辅助疗法,用于治疗INC治疗不能充分控制病情的重度慢性鼻窦炎伴鼻息肉(CRSwNP)成人患者。
Omalizumab是一款专门针对和阻断免疫球蛋白E(IgE)的抗体治疗药物,通过降低游离IgE水平、下调高亲和力IgE受体、限制肥大细胞的脱颗粒化来减少过敏性炎症级联反应中多种介导因子的释放。IgE也是慢性鼻窦炎伴鼻息肉疾病炎症通路的关键驱动因子,Omalizumab成为首个靶向和阻断IgE来治疗这类疾病的抗体药物。
(信息来源:
https://www.novartis.com/news/media-releases/novartis-receives-ec-approval-new-xolair-indication-treat-severe-chronic-rhinosinusitis-nasal-polyps)
基础研究
8月11日,Cell连续发表了两篇与TREM2靶点相关的最新研究,分别揭示了TREM2在肿瘤免疫中的部分机制。
来自华盛顿大学医学院的Marco Colonna团队研究发现,Trem2敲除的小鼠比野生型小鼠对各种癌症更有抵抗力,并且对抗PD-1疗法的反应更强。此外,与抗PD-1抗体结合使用抗TREM2 单抗,可以抑制肿瘤生长甚至促进肿瘤消退。单细胞RNA测序研究显示,TREM2缺失和抗TREM2单抗均触发肿瘤浸润细胞中MRC1+和CX3CR1+巨噬细胞亚群的下降,却引起表达改善T细胞反应的免疫刺激分子的亚群的扩张。
来自以色列魏兹曼研究所的Ido Amit团队通过分析免疫信号传导、转录因子组合和代谢活性的不同细胞内特征后发现,小鼠TREM2的遗传缺失抑制了肿瘤内调节性髓样细胞(Mreg)的积累,显著减少功能异常的CD8+T细胞,并减缓了肿瘤的生长。
TREM2是一种髓样细胞受体,具有维持小胶质细胞对神经退行性病变(例如阿尔茨海默氏病)的反应的能力,成为阿尔茨海默氏病研究中的明星分子,目前有多款靶向药物研发。TREM2在200多种人类癌症病例的肿瘤浸润巨噬细胞中表达,与癌症的生存率延长呈负相关。这两项研究揭示了TREM2在肿瘤免疫中起到的作用,通过抗TREM2 抗体重塑与肿瘤相关的巨噬细胞可能是补充检查点免疫疗法的有希望的途径。
(信息来源:
https://www.cell.com/cell/fulltext/S0092-8674(20)30878-3?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS0092867420308783%3Fshowall%3Dtrue;
https://www.cell.com/cell/fulltext/S0092-8674(20)30809-6?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS0092867420308096%3Fshowall%3Dtrue.)
Nature Cancer:“合成致死”抗癌机制的新靶点SLC33A1
6月8日,Nature Cancer发表了来自MIT的科学家团队的最新研究。在肿瘤抑制因子KEAP1(Kelch-like ECH-associated protein 1)发生突变的肺癌中,一种名为SLC33A1的蛋白能够利用被称为“合成致死”的机制抑制肿瘤生长,是一个非常有前途的抗癌靶点。
人类非小细胞肺癌(NSCLC)患者中,约有20%-30%会发生KEAP1突变,该突变与较差的生存预后有关。直接针对由于突变或缺失导致功能异常的肿瘤抑制因子基因(TSGs)开发靶向抗体疗法,尚缺少成功的案例。作为替代,“合成致死”机制是调控TSG基因发生突变后癌细胞严重依赖的另一种基因的功能,从而让二者的功能同时发生异常,抑制癌细胞生长。
研究团队使用功能基因组学方法来搜索KEAP1突变肺腺癌中环境特异性(context-specific)的必要基因来寻找“合成致死”靶点。通过使用基因工程小鼠模型,研究者发现,KEAP1缺失的肿瘤依赖于谷氨酰胺代谢途径。进一步通过CRISPR技术筛选,发现SLC33A1是KEAP1突变环境下的特异性必需基因。
在小鼠KEAP1突变癌细胞系异种移植模型以及人类KEAP1突变样本中,SLC33A1功能缺失均会抑制肿瘤生长。通过代谢组学研究分析发现,数十种代谢物(如三羧基酸循环中间代谢物、谷胱甘肽和氧化谷胱甘肽)的丰度均出现异常,导致肿瘤细胞代谢失调、未折叠蛋白反应的激活,从而引起合成致病或致死。
(信息来源:
https://www.nature.com/articles/s43018-020-0071-1?draft=collection)
版权声明
声明:以上资讯,仅供信息交流参考,不构成三优生物对外披露或投融资建议。










