- 复宏汉霖曲妥珠单抗(HLX02)获国家药监局批准上市
- 罗氏IL-6R抗体Satralizumab治疗视神经脊髓炎谱系障碍获FDA批准
-
CD19 CAR-T通过“桥接蛋白”改造获得治疗实体瘤潜力
- 科济生物靶向Claudin18.2 CAR-T疗法治疗实体瘤获CDE批准临床
药物开发
复宏汉霖曲妥珠单抗(HLX02)获国家药监局批准上市
8月14日,复宏汉霖曲妥珠单抗HLX02(商品名:汉曲优)正式获得国家药品监督管理局批准上市,用于治疗HER2阳性早期乳腺癌、HER2阳性转移性乳腺癌和HER2阳性转移性胃癌。汉曲优®此次获批了与原研产品Herceptin在中国完全相同的3个适应症。
汉曲优®成为首个由中国企业开发、生产和上市的Herceptin®(曲妥珠单抗)生物类似药,也是首个成功登陆欧盟的“中国籍”单抗生物类似药(7月27日,获欧盟委员会批准)。
(信息来源:
https://www.henlius.com/NewsDetails-2691-296.html)
CD38抗体联合蛋白酶体抑制剂和地塞米松组合疗法治疗多发性骨髓瘤获FDA批准
8月21日,强生旗下杨森(Janssen)宣布美国FDA已批准其研发的CD38抗体药物daratumumab(商品名:Darzalex)联合蛋白酶体抑制剂carfilzomib(卡非佐米,商品名:Kyprolis)以及地塞米松的组合疗法(DKd)用于治疗既往接受过1-3线治疗的复发/难治性多发性骨髓瘤(R/R MM)患者。
FDA的批准基于名为EQUULEUS的Ib期临床试验和名为CANDOR的III期临床试验。CANDOR是第一个在R/R MM患者中比较DKd组合疗法与Kyprolis和地塞米松(Kd)组合疗法的III期临床试验。该研究达到了其主要终点,与接受Kd治疗相比,接受DKd治疗的患者的疾病进展或死亡风险比Kd组合疗法降低了37%。
(信息来源:
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)30734-0/fulltext)
罗氏IL-6R抗体Satralizumab治疗视神经脊髓炎谱系障碍获FDA批准
8月15日,FDA批准罗氏IL-6R抗体Satralizumab(商品名:Enspryng)上市,用于治疗NMOSD(视神经脊髓炎谱系疾病)的儿童和成人患者。
FDA的此次批准基于两项随机对照III期临床试验(SAkuraStar和SAkuraSky)结果。SakuraStar的研究结果显示,在AQP4抗体阳性亚组中,76.5%的接受Enspryng单药治疗的患者在96周时无复发,而安慰剂组为41.1%。在评价Enspryng与基线免疫抑制剂治疗(IST)联合使用的SAkuraSky研究中,91.1%的接受Enspryng治疗的AQP4抗体阳性患者在96周时无复发,而安慰剂组为56.8%。
IL-6信号通路在NMOSD导致的相关炎症中发挥关键作用,目前Enspryng是唯一一款获批治疗NMOSD的白细胞介素-6(IL-6)单抗药物。Enspryng使用了新型再循环抗体技术设计,与传统技术相比,有更长的抗体循环时间,可以延长至每四周一次的皮下给药,所以患者或护理人在接受医疗培训后可以在家中自行给药。
(信息来源:
https://www.enspryng.com/about.html)
CD19 CAR-T通过“桥接蛋白”改造获得治疗实体瘤潜力
目前全球已上市的三款CAR-T疗法均靶向CD19,且适应症均为B细胞恶性肿瘤。BioRxiv日前刊登了Paul Rennert团队的研究论文,为CAR-T细胞高效治疗实体瘤提供了一种新的解决方案。
该解决方案是使用一种“桥接蛋白”来使CD19 CAR-T细胞获得靶向实体瘤HER2、EGFR等靶点的能力。这种桥接蛋白一头是CD19的胞外结构域(ECD),另一头是特异性识别HER2、EGFR等靶点的抗体片段。如此,靶向CD19的CAR-T细胞就能识别融合蛋白上的CD19-ECD,而融合蛋白另一端则会与实体瘤靶点特异性结合,从而使只能靶向CD19的CAR-T获得识别实体瘤靶点的能力。
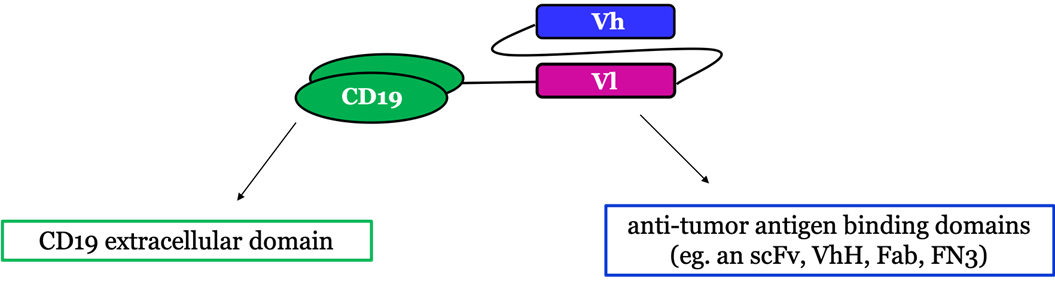
▲“桥接蛋白”改造原理
使用该技术的CAR-T疗法在小鼠实体瘤模型中获得了出色的治疗效果(临床前数据公布在SITC2018)。而使用该技术靶向HER2和CD20的CAR-T药物预计在2021年展开临床试验。
除了能够使CD19 CAR-T获得治愈实体瘤的能力以外,该技术还有望解决B细胞淋巴瘤对CD19 CAR-T的获得性耐药问题。采用识别其它抗原(如CD20)的融合蛋白,可使CD19 CAR-T细胞重新获得杀伤复发B细胞恶性肿瘤的能力(临床前数据公布在ASH2019)。
(信息来源:
https://www.biorxiv.org/content/10.1101/2020.03.25.007658v2;
http://www.aletabio.com/publications/.)
科济生物靶向Claudin18.2 CAR-T疗法治疗实体瘤获CDE批准临床
8月19日,中国国家药监局药品审评中心(CDE)最新公示,科济生物的CT041自体CAR-T细胞注射液在中国获批一项临床默示许可,适应症为“Claudin18.2阳性实体瘤”。这是中国首个针对CLDN18.2靶点的CAR-T疗法,今年5月已在美国获批临床。
CT041是一款人源化抗CLDN18.2自体CAR-T细胞注射液,用于治疗CLDN18.2表达阳性、既往经系统治疗后出现进展或复发的晚期胃腺癌/食管胃结合部腺癌、胰腺癌等。CAR-T疗法的临床效果已在血液癌症中得到验证,但是在实体瘤方面的应用瓶颈尚有待突破,因此CT041通过靶向实体瘤特异表达的肿瘤抗原,有望为实体瘤患者带来新的选择。
(信息来源:
http://www.cde.org.cn/)
临床研究
8月10日,罗氏旗下基因泰克公布了其研发的β7亚基抗体etrolizumab治疗中度至重度活动期溃疡性结肠炎(UC)患者的4项3期临床研究的最近进展。在HIBISCUS I诱导研究中,etrolizumab组达到了主要终点;在HIBISCUS II诱导研究中,etrolizumab组未达到主要终点;在HICKORY研究中,etrolizumab在诱导治疗时达到了主要终点,但在维持治疗期没有达到主要终点;在LAUREL研究中,etrolizumab作为维持治疗未能达到其主要终点。4项临床研究均未发现重大安全性问题,将在不久后公布更多数据和细节。
炎症性肠病(IBD)的两种主要类型是溃疡性结肠炎(UC)和克罗恩病(CD),约80%的IBD患者难以得到持久的缓解,影响日常生活质量。Etrolizumab是第一款可以同时靶向α4β7和αEβ7整合素的β7亚基人源化单克隆抗体。它能够同时抑制α4β7与MAdCAM-1以及αEβ7与E-cadherin的结合,从而在两个方面治疗炎症性肠病。
(信息来源:
https://www.fiercebiotech.com/biotech/hits-but-mostly-misses-for-roche-s-four-late-stage-trials-gi-drug-hopeful-etrolizumab;
https://www.gene.com/media/press-releases/14870/2020-08-09/genentech-provides-update-on-phase-iii-s#:~:text=Genentech%20Provides%20Update%20on%20Phase%20III%20Studies%20of,ulcerative%20colitis%20in%20only%20two%20of%20three%20studies.)
法规政策
8月14日,国家药品监督管理局药品审核中心发布了《生物类似药相似性评价和适应症外推技术指导原则(征求意见稿)》。作为生物类似药领域最新的技术指南,该《原则》对生物类似药的相似性评价和适应症外推进行了具体的规范。
生物类似药相似性评价应基于药学、非临床、临床比对研究结果进行综合评价,以确定候选药与参照药的整体相似性。生物类似药逐步递进研究的不同阶段均应开展相似性评价,以助于指导后续针对性开展比对研究,进而对相似性进行整体评价。
生物类似药适应症外推需满足多个条件,不能自动外推参照药的全部适应症。外推时需同时满足以下条件:
-
已使用了敏感的临床试验模型,能够检测参照药与候选药的差异;
-
临床相关的作用机制和/或相关受体相同;
-
经对生物类似药的安全性和免疫原性进行了充分的表征,并且推断的适应症没有特殊或额外的安全性问题。
(信息来源:
http://www.cde.org.cn/news.do?method=viewInfoCommon&id=b86dec18fe41c7db)
版权声明
声明:以上资讯,仅供信息交流参考,不构成三优生物对外披露或投融资建议。










