- 治疗多发性骨髓瘤的多肽药物偶联物新药melflufen获FDA优先审查
- Nature Medicine:新型双特异性CAR-T可帮助对抗HIV感染
-
Science:BTN3A1可通过协调αβ T细胞和γδ T细胞调控抗肿瘤反应
- JEM:AKT抑制剂与PD-1抗体联合用药治疗胶质母细胞瘤的机制研究
-
Cancer Cell:HPK1可成为T细胞免疫疗法新靶点
药物开发
治疗多发性骨髓瘤的多肽药物偶联物新药melflufen获FDA优先审查
8月31日,FDA受理了Oncopeptides AB公司提交的多肽药物偶联物(PDC)melflufen的新药申请(NDA),用于联合地塞米松治疗经三线治疗后的难治性/复发性多发性骨髓瘤(R/R MM)的成人患者,并给予了优先审查权。
Melflufen的上市申请基于名为HORIZON的II期临床研究结果。临床试验入组患者包括已三线治疗的难治亚组、髓外疾病亚组、具有细胞遗传学高危特征的患者亚组。其中对难治亚组的总缓解率ORR达26%、中位无进展生存期PFS达3.9个月、中位总生存期OS达11.2个月。
Melflufen为首创的多肽药物偶联物(peptide drug conjugate,PDC),由烷化剂felphalan (马法兰) 药物、Linker和肽链组成;通过肽链与氨肽酶的结合靶向肿瘤细胞,并发挥药物的杀伤作用。肽酶在蛋白质稳态中起关键作用,并在细胞进程(例如细胞周期进程和程序性细胞死亡)中发挥重要作用。研究发现,在R/RMM细胞中,氨基肽酶高表达。
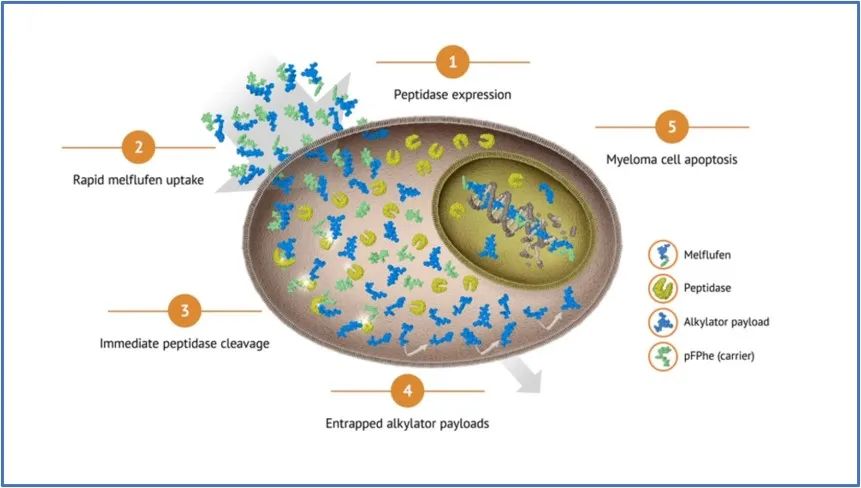
▲ Melflufen机制原理
(信息来源:
https://www.prnewswire.com/news-releases/fda-grants-priority-review-of-melflufen-for-patients-with-triple-class-refractory-multiple-myeloma-301120645.html)
Nature Medicine:新型双特异性CAR-T可帮助对抗HIV感染
8月31日,Nature Medicine发表了来自Jim Riley教授等团队的最新研究。该研究设计了一种新型双特异性CAR-T细胞免疫疗法,能够特异性靶向感染HIV的细胞,帮助对抗HIV感染。在HIV感染的小鼠模型中,CAR-T细胞治疗让HIV复制速度变慢、血液中的HIV病毒数量减少、被病毒感染的细胞减少。
因为HIV主要感染T细胞,这种新型CAR-T细胞要能够杀伤HIV感染细胞以外,还需要在体内存活且避免被HIV感染。这种CAR-T细胞装备了两种CAR;它们共有CD4蛋白胞外域,能够靶向HIV感染的细胞;此外,两种CAR分别包含4-1BB/CD3-ζ和CD28/CD3-ζ胞内域,前者可以刺激T细胞增殖和持久性,后者用来增强T细胞杀死被感染细胞的能力。与此同时,这种CAR-T细胞上还添加了膜融合抑制剂C34-CXCR4,用于防止HIV附着,起到保护CAR-T细胞免受HIV感染的作用。
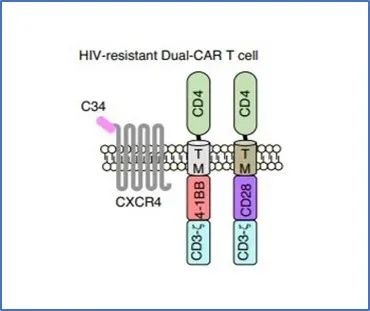
▲ 新型靶向HIV 双特异性CAR-T细胞机制示意图
(信息来源:
https://www.nature.com/articles/s41591-020-1039-5)
诺华新型三特异性抗体专利公开
8月28日,诺华三特异性抗体专利CN201880086747.X公开,涵盖了多个肿瘤相关抗原靶点,对其功能机制进行了深入研究,且已建构了成熟骨架,可以为更多的生物制药企业在多特异性抗体赛道提供宝贵的经验。
该三特异性抗体靶向CD3/CD2/TAA,分子结构具有固定的模板,分别特异性结合至人CD2的抗原结合模块1 (ABM1) ;特异性结合至人T细胞受体 (TCR) 复合物的组分即CD3的抗原结合模块2 (ABM2) ;特异性结合至人肿瘤相关抗原 (TAA) 的抗原结合模块3 (ABM3) 。
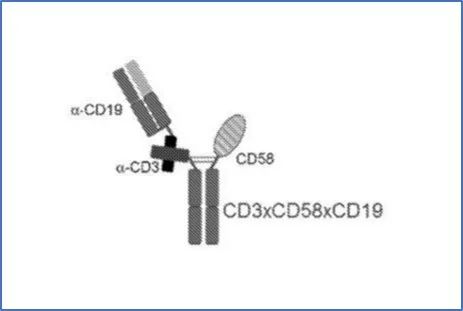
▲ 诺华三特异性抗体典型案例,其中结合CD2部分为CD2配体CD58的IgV结构域
从专利中数据可知,诺华靶向CD3/CD2/CD19三特异性抗体表现出了更强的活性和持久性。从细胞因子的诱导释放来看,靶向CD3/CD2/CD19三特异性抗体的免疫活性比对应的靶向CD3/CD19双抗强1-2个数量级。
(信息来源:
http://www.soopat.com/Patent/201880086747)
阿斯利康PD-L1单抗durvalumab获欧盟批准用于一线治疗广泛期小细胞肺癌
9月1日,阿斯利康宣布,欧盟委员会(EC)已批准抗PD-L1单抗durvalumab(商品名:Imfinzi)联合含铂化疗(依托泊苷+卡铂或顺铂),用于一线治疗广泛期小细胞肺癌(ES-SCLC)成人患者。
该适应症批准基于名为CASPIAN的III期临床试验的结果。CASPIAN试验比较了Imfinzi+含铂化疗 (依托泊苷+卡铂或顺铂) 、Imfinzi+tremelimumab+含铂化疗、含铂化疗三种方案一线治疗ES-SCLC患者的疗效和安全性。数据显示(2020年5月),Imfinzi+含铂化疗维持死亡风险比单独含铂化疗组降低了25%;中位总生存期OS 12.9个月,24个月无进展生存率11%, 显著高于单独含铂化疗组的10.5个月和2.9%;且安全性及耐受性符合要求。
Imfinzi是一种人源化的PD-L1单克隆抗体,能够阻断PD-L1跟PD-1和CD80的结合,从而阻断肿瘤免疫逃逸并促进免疫反应。
(信息来源:
https://www.astrazeneca.com/media-centre/press-releases/2020/imfinzi-approved-in-EU-for-small-cell-lung-cancer.html)
基础研究
8月21日,Science发表了来自H. Lee Moffitt癌症中心研究团队的最新研究。已知嗜乳脂蛋白BTN3A1过表达可以提高 γδ T细胞的浸润,该研究发现嗜乳脂蛋白BTN3A1抑制肿瘤反应性αβ T细胞的激活的机制;进一步小鼠模型发现抗BTN3A1的抗体治疗不仅能够重塑 αβ T细胞的抗肿瘤效应,还能恢复γδ T细胞对表达BTN3A1癌细胞的细胞毒性作用。
研究人员构建了过表达BTN3A1的(MHC-I-)CD32+K562人工抗原提呈细胞(BTN-K32 aAPCs),通过体外T细胞-抗原提呈细胞共培养实验等实验发现BTN3A1是通过阻断N-糖基化CD45从免疫突触的分离,从而有效阻碍免疫突触的形成,最终抑制αβ T细胞的活化及效应功能。研究人员构建了人卵巢癌小鼠肿瘤模型,结果发现靶向BTN3A1的抗体治疗能同时增强了αβ T细胞和γδ T细胞的抗肿瘤效应,且抑瘤效果优于抗PD-1抗体nivolumab。在过表达BTN3A1的转基因小鼠中也观察到了类似的结果。
靶向BTN3A1的治疗手段不仅能够协同 αβ T 和γδ T细胞来杀伤已确立的肿瘤,同时对耐受现有免疫疗法的肿瘤提出一个全新的潜在治疗策略。
(信息来源:
https://science.sciencemag.org/content/369/6506/942)
JEM:AKT抑制剂与PD-1抗体联合用药治疗胶质母细胞瘤的机制研究
8月27日,Journal of Experimental Medicine在线发表了来自吕建新/吕志民团队的最新研究。该研究发现了胶质母细胞瘤(GBM)中AKT/β-catenin通路对免疫检查点PD-L1调控的机制,且在小鼠GBM模型中,发现AKT抑制剂与PD-1抗体联合用药疗效优于单药治疗。
研究人员通过胶质瘤标本分析,发现激活的β-catenin水平与PD-L1表达水平呈正相关,而与肿瘤组织中浸润的CD8+T细胞数呈负相关。进一步研究发现Wnt通路和EGFR通路激活均可促使β-catenin激活,随后引起PD-L1的表达水平升高;同时,研究人员还发现AKT介导了Wnt通路和EGFR通路对β-catenin/PD-L1的调控作用。基于该研究结果,研究人员使用AKT抑制剂MK2206与PD-1抗体联合用药治疗小鼠GBM模型,发现联合用药不但能更有效地促进肿瘤中CD8+T细胞的浸润水平,同时还能更显著地延长荷瘤小鼠的生存期,治疗效果远好于单药治疗。
胶质母细胞瘤是一类常见的原发性恶性脑肿瘤。GBM患者经过手术放化疗等治疗手段后,其生存中位数仅为14个月左右,五年的生存率仍不到5%,因此GBM是当今肿瘤治疗中的重大挑战之一。
(信息来源:
https://rupress.org/jem/article/217/11/e20191115/152055/Catenin-induces-transcriptional-expression-of-PD?searchresult=1)
Cancer Cell:HPK1可成为T细胞免疫疗法新靶点
8月28日,Cancer Cell发表了来自廖学斌/魏来团队的最新研究。该研究发现HPK1是T细胞功能障碍的介体,敲除编码HPK1的MAP4K1可改善T细胞的衰竭,且可提高CAR-T免疫治疗疗效。
研究人员发现,HPK1-NFκB-Blimp1信号轴介导T细胞功能障碍,MAP4K1(编码HPK1)的高表达与T细胞衰竭增加和某些癌症类型患者的较差生存有关。进一步,研究人员构建了MAP4K1KO小鼠模型,发现MAP4K1敲除小鼠中肿瘤的生长比野生型小鼠慢,并且浸润性T细胞的衰竭程度降低,活性和增殖性更高。进一步实验发现,药理学抑制、蛋白水解、或靶向嵌合体(PROTAC)介导的HPK1耗竭,在各种临床前血液和实体瘤的小鼠模型中提高了CAR-T细胞免疫疗法的功效。这些策略比在CAR-T细胞中遗传敲除PD-1更有效。
恢复T细胞活力的癌症免疫疗法(例如检查点抑制剂疗法)已在临床收到疗效,但许多患者未达到持久反应,其可能原因是衰竭的T细胞处于稳定的表观遗传状态,从而限制了活力恢复。本次研究揭示HPK1可成为稳定调节T细胞衰竭或功能障碍的可药物化靶标。
(信息来源:
https://www.cell.com/cancer-cell/fulltext/S1535-6108(20)30375-5)
版权声明
声明:以上资讯,仅供信息交流参考,不构成三优生物对外披露或投融资建议。










