- NEJM:PD-L1单抗Avelumab一线维持治疗尿路上皮癌III期临床结果公布
- ESMO:Trop-2 ADC药物Trodelvy治疗三阴性乳腺癌III期临床结果公布
-
ESMO:CD19/CD22 CAR-T治疗R/R弥漫性大B细胞淋巴瘤I/II期临床结果公布
- Cell:靶向CD19的CAR-T疗法神经毒性副作用的产生机制
药物开发
ADC Therapeutics提交首个CD19 ADC药物上市申请
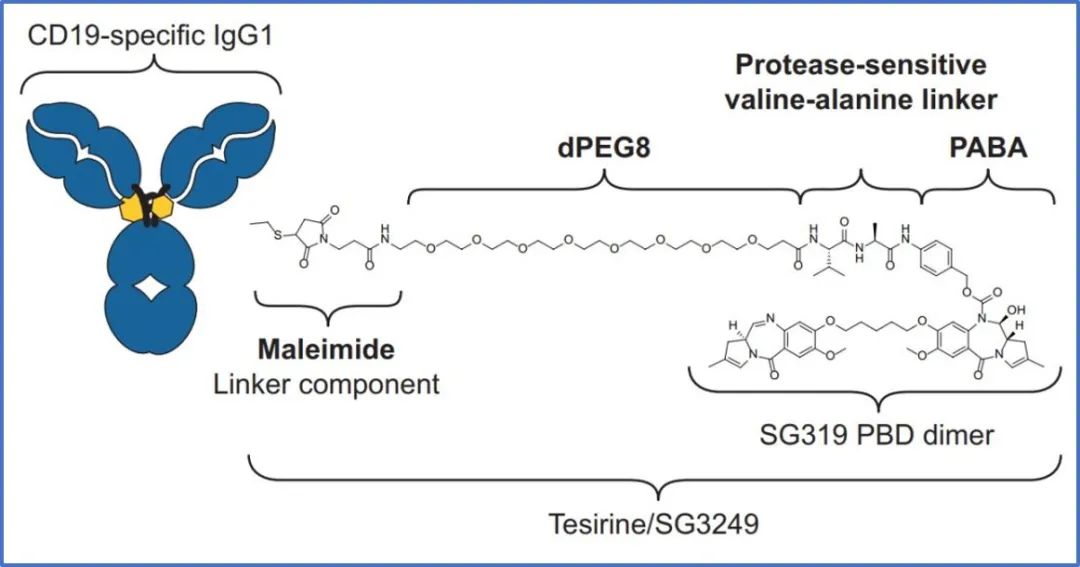
9月21日,ADC Therapeutics宣布,向FDA提交了ADC候选药物loncastuximab tesirine(Lonca,原代号ADCT-402)的生物制剂许可申请(BLA),用于治疗复发/难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)。
本次BLA申请基于Lonca二线治疗R/R 弥漫大B细胞淋巴瘤(DLBCL)II期临床结果。结果显示,总缓解率(ORR)达到48.3%,完全缓解率(CR)为24.1%,安全性可控。
Lonca是一款靶向CD19抗原的ADC,由与CD19结合的人源化单克隆抗体与吡咯苯二氮平(PBD)二聚体毒素偶联构成。一旦与CD19表达细胞结合,loncastuximab tesirine会被内化到细胞中,并释放基于PBD的弹头。
(信息来源:
www.businesswire.com/news/home/20200921005826/en)
BMS&蓝鸟BCMA CAR-T疗法上市申请获FDA优先审评
9月22日,百时美施贵宝(BMS)和Bluebird Bio联合宣布,美国FDA已接受idecabtagene vicleucel(ide-cel,又名bb2121)的生物制品许可申请(BLA)并授予优先审评资格,用于治疗接受过3种以上疗法(包括免疫调节剂、蛋白酶体抑制剂和抗CD38抗体)的多发性骨髓瘤的成年患者。
本次BLA申请基于评估Ide-cel治疗已重度治疗的高度难治性多发性骨髓瘤患者疗效和安全性的II期临床试验KarMMa。结果显示,总缓解率(ORR)达到73%,中位无进展生存期(PFS)为8.6个月,安全性方面最常见的毒性是血细胞减少(97%)和细胞因子释放综合征(CRS;84%),仅有5例(5%)为3级,1例为4级,1例为5级。
Ide-cel是一种靶向B细胞成熟抗原(BCMA)的嵌合抗原受体(CAR)T细胞免疫疗法,此前已获得FDA突破性疗法认定,以及欧洲药品管理局的PRIME资格认定。
(信息来源:
https://www.cancernetwork.com/view/fda-grants-priority-review-to-idecabtagene-vicleucel-for-multiple-myeloma)
临床研究
9月24日,NEJM发表了PD-L1单抗avelumab一线维持治疗尿路上皮癌III期临床试验结果。结果显示:avelumab+最佳支持治疗(BSC)组相比对照组显著延长了中位总生存期(21.4 vs 14.3个月),总体人群的死亡风险降低31%。随访1年时,avelumab+BSC组和对照组的总生存率分别为71.3%和58.4%。在PD-L1阳性人群中,avelumab+BSC组相比对照组也显著延长了中位OS。
Avelumab是一种PD-L1抑制剂,今年7月1日,FDA批准其用于一线维持治疗接受含铂化疗后未进展的局部晚期或转移性尿路上皮癌(UC)患者,也是近30年来批准的首个也是唯一一个成功改善晚期尿路上皮癌患者总生存期的一线免疫疗法。
(信息来源:
https://www.nejm.org/doi/10.1056/NEJMoa2002788)
ESMO:Trop-2 ADC药物Trodelvy治疗三阴性乳腺癌III期临床结果公布
9月18日,ESMO大会公布了Trop-2 ADC药物Trodelvy治疗既往已经接受2种以上疗法的成人转移性三阴性乳腺癌患者III期临床结果。结果显示:Trodelvy治疗组中位无进展生存期(PFS)为5.6个月,化疗治疗组中位PFS为1.7个月;Trodelvy治疗组可使疾病进展风险降低59%;安全性方面,Trodelvy治疗组未见严重心血管毒性事件,未见2级以上神经毒性事件和3级以上间质性肺病事件,未见治疗导致的死亡病例,不良事件导致治疗终止的发生率低于TPC对照组(4.7% vs 5.4%)。
今年4月22日,Trodelvy被FDA加速批准用于既往已经接受2种以上疗法的成人转移性三阴乳腺癌。Trodelvy又名sacituzumab govitecan,是一种由靶向Trop-2的人源化IgG1抗体与化疗药物伊立替康的代谢活性产物SN-38偶联而成的新型抗体药物偶联物(ADC)。TROP-2是一种在90%以上的三阴性乳腺癌(TNBC)中表达的细胞表面糖蛋白。
(信息来源:
https://www.esmo.org/meetings/esmo-virtual-congress-2020/daily-reporter/daily-reporter-news/ascent-a-landmark-advance-in-treating-refractory-triple-negative-breast-cancer)
ESMO:CD19/CD22 CAR-T治疗R/R弥漫性大B细胞淋巴瘤I/II期临床结果公布
9月18日,ESMO大会公布了CD19/CD22双特异性CAR-T产品AUTO3治疗复发/难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)I/II期临床结果。结果显示:CAR-T治疗组客观缓解率(ORR)为68%,完全缓解率(CR)为54%;在第一天接受pembrolizumab预处理的CAR-T治疗组中,ORR为71%,CR为64%;在中位随访为6个月的所有剂量队列中,达到完全缓解的患者中有93%未复发。安全性方面AUTO3的耐受性良好,没有≥3级的细胞因子释放综合征(CRS),神经毒性(NT)发生率较低。
AUTO3包含了靶向CD19和CD22的两个独立嵌合抗原受体,并分别针对单个靶标进行了活性优化。通过同时靶向两种B细胞抗原,AUTO3减少B细胞恶性肿瘤患者因单一抗原丢失而引起的复发。
(信息来源:
https://autolus.gcs-web.com/news-releases/news-release-details/autolus-therapeutics-presents-additional-data-auto3-dlbcl-0)
ESMO:PD-1抑制剂Opdivo组合疗法一线治疗晚期肾细胞癌III期临床结果公布
9月19日,ESMO大会公布了PD-1抑制剂Opdivo(nivolumab)与酪氨酸激酶抑制剂Cabometyx(cabozantinib)联用一线治疗晚期肾细胞癌(RCC)的关键性III期临床试验CheckMate-9ER结果。结果显示:与对照组相比,Opdivo组合疗法将患者死亡风险降低40%,接受Opdivo组合疗法治疗的患者的无进展生存期(PFS)为16.6个月,是对照组(8.3个月)的两倍;Opdivo组合疗法的客观缓解率(ORR)为56%,也达到对照组(27%)的两倍;所有疗效数据在各种转移性肾细胞癌亚群中表现一致,包括表达不同PD-L1水平的患者亚群。
Opdivo于2014年7月在日本率先获得批准,是全球获批的首款PD-1免疫疗法。基于本次III期临床积极结果,BMS和Exelixis公司已经向欧盟和美国的监管机构递交了监管申请。
(信息来源:
https://news.bms.com/news/corporate-financial/2020/Opdivo-nivolumab-in-Combination-with-CABOMETYX-cabozantinib-Demonstrates-Significant-Survival-Benefits-in-Patients-with-Advanced-Renal-Cell-Carcinoma-in-Pivotal-Phase-3-CheckMate--9ER-Trial/default.aspx)
基础研究
9月21日,Cell发表了来自斯坦福大学医学院研究团队的最新研究。该研究发现,脑壁细胞中表达CD19是靶向CD19的CAR-T疗法产生神经毒性的原因,并提示了抗CD19疗法中神经毒性的靶向机制。
根据单细胞图谱数据并结合蛋白质水平的染色实验,研究人员证实,在人类大脑中的壁细胞(mural cells)表面有CD19表达。这类细胞包裹在血管周围,是血脑屏障的重要组成部分。
研究人员使用靶向鼠源CD19的CAR-T细胞治疗小鼠模型,小鼠血脑屏障通透性增加,发现神经毒性现象;而对照组,使用靶向人CD19的CAR-T细胞治疗小鼠模型,未发现神经毒性现象。且当CAR-T细胞使用不同的T细胞共刺激蛋白域时,对血脑屏障造成的渗漏程度不同,与临床上观察到的不同CAR-T疗法相关的神经毒性发生频率具有相关性,且这种神经毒性通常是暂时的,经过及时处理可以康复。
(信息来源:
https://doi.org/10.1016/j.cell.2020.08.022)
版权声明
声明:以上资讯,仅供信息交流参考,不构成三优生物对外披露或投融资建议。










