- 靶向CD19的ADC药物Lonca获FDA优先审评资格
- 罗氏公布TCRL筛选新技术CAR-J
- TCR疗法tebentafusp III期临床试验成功
- 蛋白质结构预测算法AlphaFold获突破,预测水平与真实实验结果相当
药物开发
靶向CD19的ADC药物Lonca获FDA优先审评资格
11月20日,ADC Therapeutics宣布,其创新抗体药物偶联物(ADC)loncastuximab tesirine(Lonca)的生物制品申请许可申请获FDA受理,并获得了优先审评资格,其有望成为第一个获批的靶向CD19的ADC药物。
此次BLA申请基于Lonca治疗已接受两线或更多线治疗的复发/难治性弥漫大B细胞淋巴瘤(DLBCL)患者的II期临床试验积极数据。截至2020年4月6日,该疗法的总缓解率达48.3%(70/145),完全缓解率为24.1%(35/145)。
Lonca是由人源化的抗CD19单克隆抗体与吡咯并苯并二氮(PBD)二聚体细胞毒素连接构成。一旦与表达CD19的细胞结合,它就能够被细胞内化,并释放细胞毒素。这种创新细胞毒素能够不可逆地与DNA结合,产生高效的链间交联,阻止DNA链分离,从而破坏基本的DNA新陈代谢过程,最终导致细胞死亡。
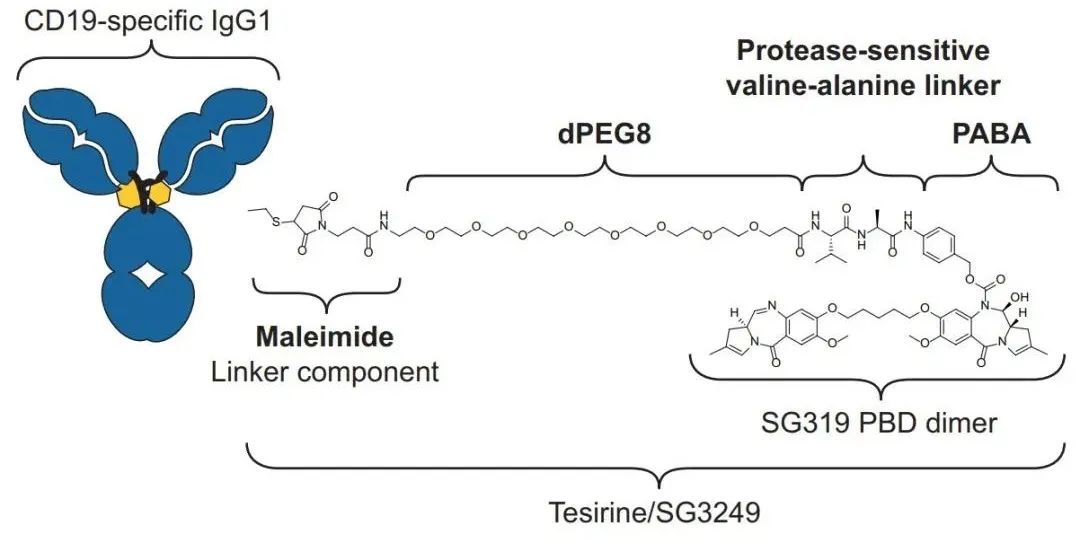
▲ lonca的结构示意图
(信息来源:
https://ir.adctherapeutics.com/press-releases/press-release-details/2020/ADC-Therapeutics-Announces-FDA-Accepts-Biologics-License-Application-and-Grants-Priority-Review-for-Loncastuximab-Tesirine-for-Treatment-of-Relapsed-or-Refractory-Diffuse-Large-B-cell-Lymphoma/default.aspx)
罗氏公布TCRL筛选新技术CAR-J
11月2日,mAbs期刊在线发表了来自罗氏科学家团队的最新研究,该研究开发了一种新型CAR-J 细胞,可用于快速筛选并优化TCR样抗体(TCRL)。
TCRL(TCR-like antibodies)是人白细胞抗原(HLA)表位的 TCR 样抗体,可针对肿瘤细胞内的抗原。TCRL 可以与荧光试剂偶联,检测肿瘤细胞表面多肽-MHC复合物(pMHC)的表达水平,也可以与 pMHC结合直接诱导肿瘤细胞死亡。TCR样抗体可以转化为CAR 结构,由TCR样抗体介导的 CAR-T 细胞治疗被认为对实体瘤有效。
目前TCRL的筛选通常是以TCB形式进行,即通过构建一种工程免疫球蛋白,将T细胞受体(TCR)CD3e单链及肿瘤相关抗原结合。该种方法工作量巨大,且效率较低。此次由罗氏科学家研发的CAR-J新技术,采用将TCRL候选物嵌入到嵌合抗原受体(CARs)上,形成TCRL-Fab-CAR分子,并将其转导到Jurkat细胞中表达,然后评估候选物的特异性。CAR-J 细胞具有NFAT荧光素酶系统,与靶细胞结合即可激活T细胞,荧光强弱反映结合强度。这种方式不仅可以快速筛选 TCRL,还可以反映结合强度,对于TCRL的筛选和鉴定有很大帮助。
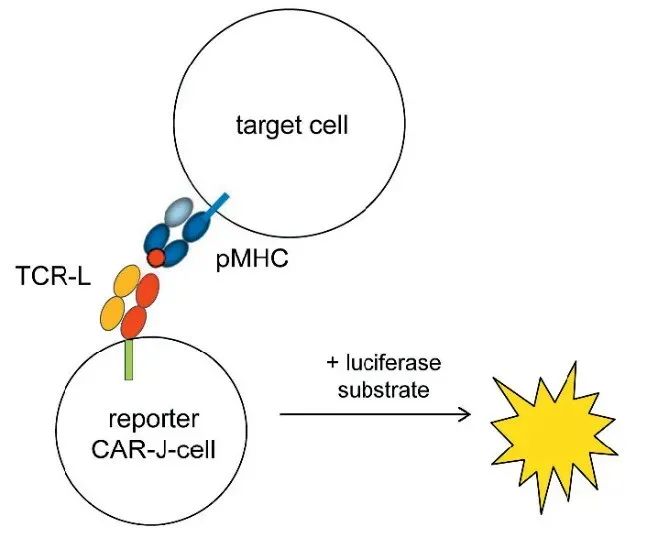
▲ CAR-J细胞筛选原理
(信息来源:
https://www.tandfonline.com/doi/full/10.1080/19420862.2020.1840709)
强生EGFR/c-Met双抗amivantamab申请上市
12月3日,强生旗下杨森公司宣布向FDA提交了EGFR/c-Met双抗amivantamab的上市申请,用于治疗铂类化疗后进展的EGFR外显子20插入突变的转移性非小细胞肺癌(NSCLC)患者。针对该适应症,amivantamab已在今年3月获得了FDA授予的突破性疗法资格。
强生此次提交上市申请是凭借amivantamab治疗的I期CHRYSALIS研究积极数据。数据显示,全部39例可评估患者的客观缓解率(ORR)为36%,中位缓解持续时间(DOR)为10个月,中位无进展生存期(PFS)为8.3个月;既往接受过含铂化疗患者的ORR为41%(12/29),中位DOR为7个月,中位PFS为8.6个月。
在最新的ESMO2020大会上,强生公布了amivantamab联合口服lazertinib的疗效数据。在20例初次接受治疗的患者组中,中位随访时间为7个月时,客观缓解率达到100%。在 45例奥希替尼耐药、未接受过化疗患者中,联合疗法的客观缓解率达到36%,其中包括1 例患者完全缓解,15例患者部分缓解。
Amivantamab是一种EGFR-MET 双特异性抗体,能够同时抑制EGFR及MET的磷酸化,以及下游信号的激活,并且有较强的抗体依赖性细胞介导的细胞毒作用(ADCC)。
▲ Amivantamab作用机制
(信息来源:
https://www.onclive.com/view/fda-approval-sought-for-amivantamab-for-metastatic-egfr-exon-20-positive-nsclc)
临床研究
11月23日,Immunocore公司宣布其研发的创新T细胞受体(TCR)疗法tebentafusp治疗转移性葡萄膜黑色素瘤患者的III期临床试验取得积极中期结果,显著提升了所治疗癌症患者的总生存率(OS)。Tebentafusp组目前的一年生存率为73%,优于其他疗法组的58%,且该疗效数据与其II期临床具有一致性。
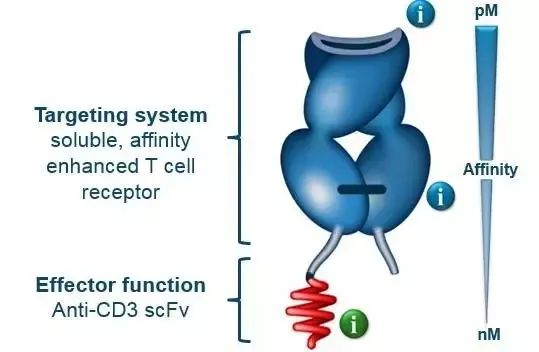
Tebentafusp是一种靶向gp100的TCR疗法,由特异性结合黑色素细胞抗原 gp100 的mTCR和anti-CD3 scFv组成,其中TCR负责特异识别抗原,而抗CD3 scFv负责募集并激活T细胞,从而实现对癌细胞的靶向性杀伤。TCR介导的肿瘤靶向的主要优势在于,与抗体不同,TCR可以通过识别肿瘤细胞表面的多肽-HLA抗原复合物来靶向位于细胞内的抗原,这有望突破现有抗体类药物的局限,大大扩增可识别靶点的数量。此外,基于现有的T细胞浸润人类肿瘤的机制,TCR技术也有望用于治疗免疫学上的“冷肿瘤”。

▲ Tebentafusp结构原理
(信息来源:
https://www.immunocore.com/news/immunocores-tebentafusp-demonstrates-superior-overall-survival-compared-investigators-choice-phase-3-clinical-trial-patients-pre;
https://www.sciencedirect.com/science/article/abs/pii/S0161589015000346)
基础研究
11月30日,DeepMind公司宣布,其新一代AlphaFold人工智能系统,在国际蛋白质结构预测竞赛(CASP)上击败了其余的选手,AlphaFold系统对所有近100个蛋白靶点3D结构预测的中位GDT评分为92.4分。即便是针对最难解析的蛋白靶点,AlphaFold的中位GDT评分也达到了87.0分,而学界一般认为,一个预测工具的GDT得分在90分左右即可认为与真实实验结果相当。
AlphaFold采用深度学习与“tension algorithm”结合的方式,这种算法模仿了组装拼图的方式:首先将小块的碎片连接起来,然后寻找将小块连接成一个更大的整体的方法。随后DeepMind在由128个处理器组成的计算机网络上,用17万个已知的蛋白质结构对AlphaFold算法进行训练。由于AlphaFold在本次CASP竞赛中的成绩过于优异,主办方担心DeepMind可能以某种方式作弊,因此设置了一个特殊的挑战:预测一种古菌的特殊膜蛋白结构。这个蛋白此前从未公布过结构数据,并困扰了Lupas教授研究团队十年之久。AlphaFold提供的预测模型让Lupas和他的同事理解了他们之前得到的X射线数据。随后的分析结果更证实,AlphaFold预测的结构与实验室的数据相吻合。
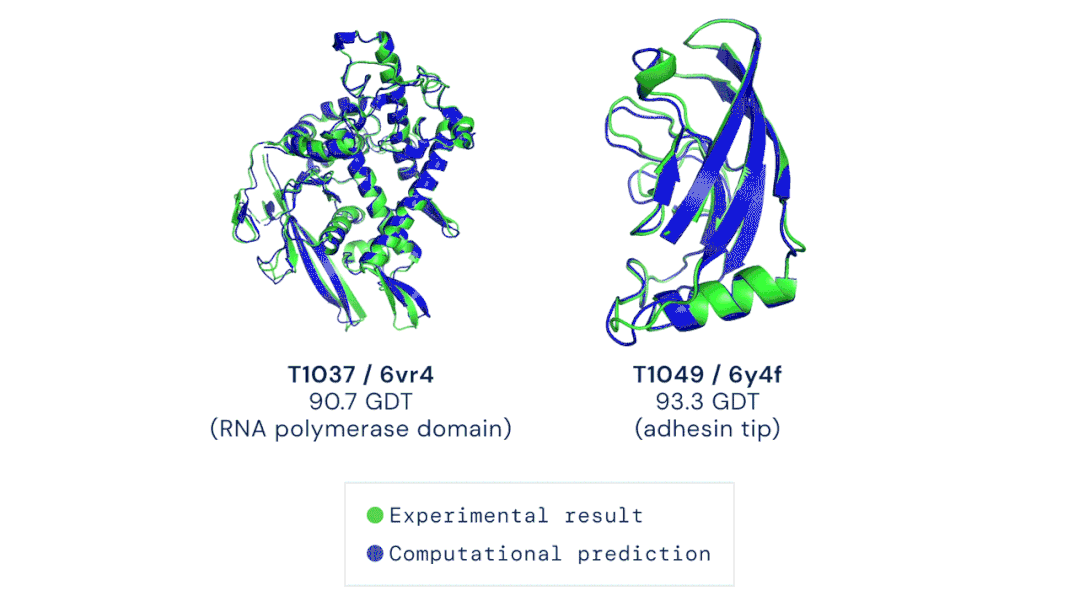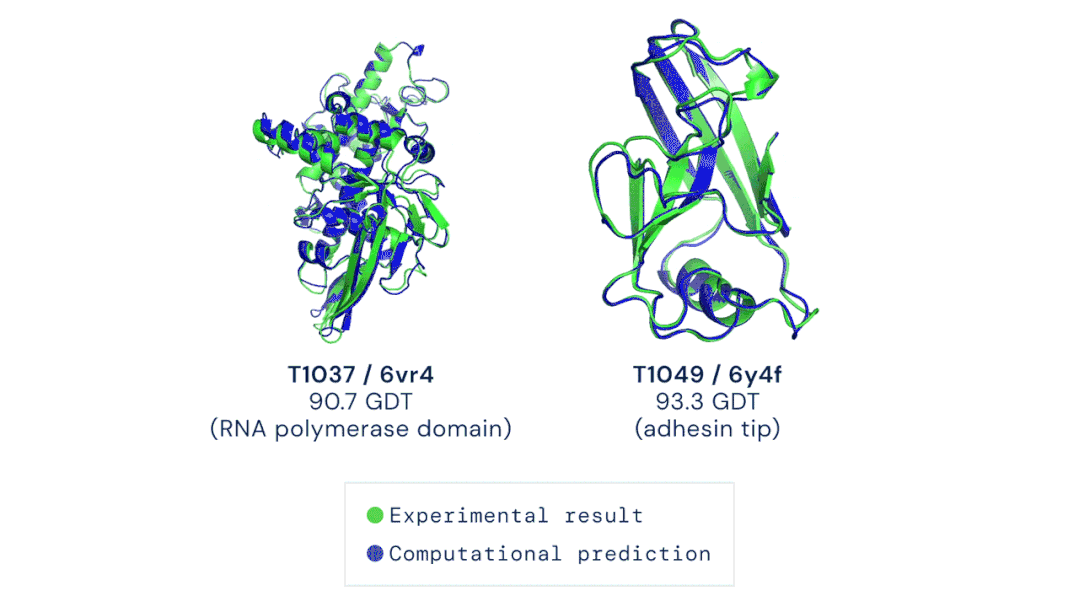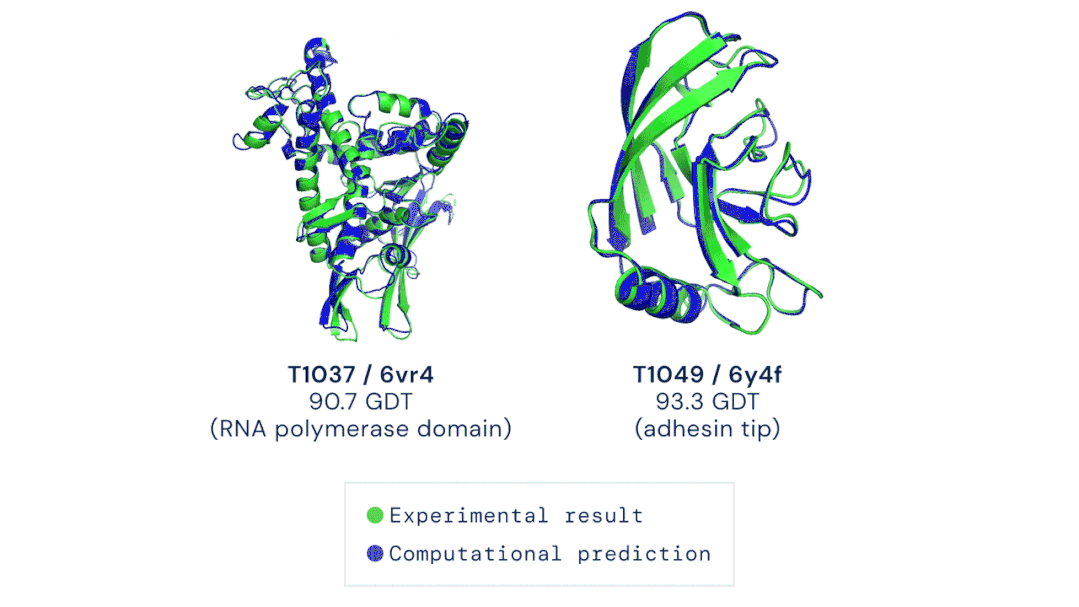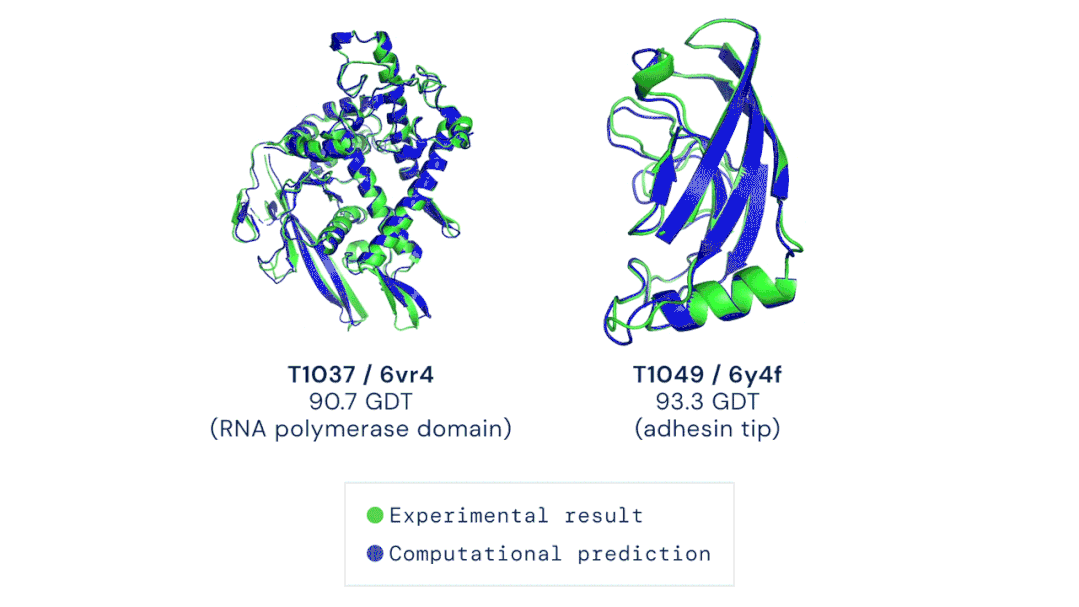
▲ AlphaFold根据氨基酸序列预测的蛋白结构与实验手段解析的
结果几乎完全重合(绿色,实验结果;蓝色,计算预测结果;)
此前30年中,人工预测蛋白质结构软件在CASP竞赛中的最高得分长期在40分左右徘徊。2018年,第一代AlphaFold将记录提高到了接近60分。此次第二代AlphaFold的重大突破意味着生物学家们或许将可以使用计算结构预测作为科学研究的重要核心工具之一。值得一提的是,AlphaFold很擅长解决那些被夹在细胞膜中的蛋白质的结构,这些结构很难用X射线晶体学解决,然而这些蛋白质结构又是许多疾病的关键所在。
(信息来源:
https://deepmind.com/blog/article/alphafold-a-solution-to-a-50-year-old-grand-challenge-in-biology)
巨噬细胞免疫新靶点MARCO
11月23日,PNAS发表了来自瑞典Karolinska研究所领衔团队的最新研究,该研究发现了靶向巨噬细胞表面清道夫受体MARCO抗体调节肿瘤生长的分子机制,并发现MARCO抗体与免疫检查点抑制剂的协同疗效。
研究人员使用MARCO抗体靶向表达MARCO的巨噬细胞,发现MARCO抗体治疗的肿瘤末端节点密度较低,且每个血管节点的距离较长,表明靶向肿瘤内血管周围表达MARCO的巨噬细胞可以影响血管形成。进一步的研究发现,MARCO抗体能诱导受体迅速内化和细胞外ATP的释放,通过嘌呤受体P2X7R和低氧诱导因子-1(HIF-1)来调节肿瘤中的微血管,并通过增加巨噬细胞的代谢活性来改变细胞的极化和炎症表型。通过黑色素瘤小鼠模型,研究人员发现,MARCO抗体治疗会使小鼠血清中IL-15水平升高,激活NK细胞增强肿瘤杀伤作用,且单独使用MARCO抗体治疗与PD-1/L1抗体单药治疗的疗效相似,但联合治疗更有效。
MARCO抗体治疗仅依赖于NK细胞,而不依赖于T细胞,通过直接激活NK细胞杀伤肿瘤。提供一条与免疫检查点阻断不同的肿瘤杀伤途径,为免疫检查点抑制剂的耐药提供了新的疗法。
(信息来源:
https://www.pnas.org/content/early/2020/11/20/2015343117)
胰腺癌新靶点NetG1
11月30日,Cancer Discovery发表了来自美国Fox Chase癌症中心的最新研究,该研究发现表达轴突生长诱向因子G1(NetG1)的癌相关成纤维细胞(CAF)具有免疫抑制作用,能抑制NK细胞介导的肿瘤细胞杀伤作用,且在使用NetG1抗体后,小鼠胰腺肿瘤的负担显著减小。
研究人员发现,在胰腺导管腺癌小鼠模型中敲除CAF中的NetG1和肿瘤细胞中的NGL-1都会减少小鼠的肿瘤负担,这表明两种蛋白能增强肿瘤的发生。进一步显示,CAF中NetG1的表达为胰腺癌创造了一个免疫抑制的微环境,NK细胞在这一环境中失活,保护了癌细胞免受NK细胞的杀伤作用,而CAF中NetG1表达缺失能逆转一部分CAF的免疫抑制能力,使NK细胞保持其活性并清除了癌细胞。之后,研究人员分别在体外和体内验证了靶向NetG1抗体的治疗潜力,结果发现,NetG1单抗治疗可减少CAF产生的促炎细胞因子,且小鼠肿瘤重量减轻,胰腺重量减少,肿瘤面积减少,坏死更严重,NetG1单抗治疗组小鼠的肿瘤中NK细胞浸润面积更大。
该研究确定了NetG1是一个在胰腺癌治疗中很有希望的靶点,并初步验证了NetG1抗体的治疗潜力。
(信息来源:
https://cancerdiscovery.aacrjournals.org/content/early/2020/10/30/2159-8290.CD-20-0775.long)
版权声明
声明:以上资讯,仅供信息交流参考,不构成三优生物对外披露或投融资建议。










